
สสารรอบตัวเราถูกสร้างขึ้นจากอะตอม ทั้งนี้ในการศึกษาเรื่องอะตอม ผู้เรียนจำเป็นจะต้องเข้าใจความหมายของ ไอโซโทป (Isotope) คืออะไร และความรู้เรื่องไอโซโทปนี้นำไปใช้ประโยชน์ทางวิทยาศาสตร์ได้อย่างไร บทความนี้มีความรู้เรื่องไอโซโทปมาฝาก
อะตอม คืออะไร ?
ก่อนที่เราจะไปรู้จักกับ ไอโซโทป isotope คืออะไรนั้น เราต้องทำความเข้าใจเกี่ยวกับ อะตอม (Atomic) กันก่อน สสารรอบตัวเราถูกสร้างขึ้นจากอะตอม โดยอะตอมประกอบไปด้วยอนุภาค 3 ชนิด คือ โปรตรอน นิวตรอนและอิเล็กตรอน โปรตรอนที่มีประจุเป็นบวกและนิวตรอนที่เป็นกลางทางไฟฟ้าจะเกาะกันอยู่ที่ใจกลางอะตอม เรียกว่า นิวเคลียส และอิเล็กตรอนที่มีประจุเป็นลบ จะโคจรอยู่รอบ ๆ นิวเคลียส
เลขอะตอม เลขมวล คืออะไร
เลขอะตอม (Atomic number, Z)
จำนวนโปรตอนในนิวเคลียสของอะตอมของธาตุ ในอะตอมที่เป็นกลางจะมีจำนวนโปรตอนเท่ากับจำนวนอิเล็กตรอน ดังนั้นเลขเชิงอะตอม จึงบอกจำนวนของอิเล็กตรอนของธาตุได้
เลขมวล (Mass number, A)
ผลรวมของนิวตรอนและโปรตอนที่มีในนิวเคลียสของอะตอมของธาตุ นิวเคลียสในอะตอมอื่น ๆ ทั้งหมดจะมีทั้งโปรตอนและนิวตรอนอยู่
สัญลักษณ์นิวเคลียร์ (Nuclear symbol)
เป็นสัญลักษณ์ที่แสดงจำนวนอนุภาคมูลฐานของอะตอมด้วยเลขมวลและเลขอะตอม เขียนแทนด้วยสัญลักษณ์ดังนี้
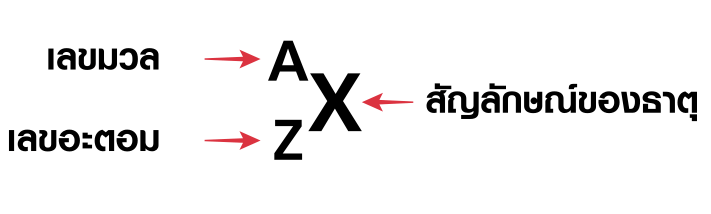
ไอโซโทป (isotope) คืออะไร แตกต่างกันอย่างไร?
ไอโซโทป หมายถึง อะตอมของธาตุชนิดเดียวกันที่มีเลขอะตอม (Z) เท่ากัน แต่เลขมวล (A) ไม่เท่ากัน ตัวอย่างเช่น อะตอมของไฮโดรเจนมีเลขมวลสามชนิดโดยแตกต่างกันที่จำนวนนิวตรอน ได้แก่
ไฮโดรเจน (Hydrogen)
มี 1 โปรตอนและไม่มีนิวตรอน มีสัญลักษณ์ 11H
ดิวทีเรียม (Deuterium)
มี 1 โปรตอนและมี 1 นิวตรอน มีสัญลักษณ์ 21H
ทริเทียม (Tritium)
มี 1 โปรตอนและมี 2 นิวตรอน มีสัญลักษณ์ 31H
เมื่อเรามีความเข้าใจเกี่ยวกับไอโซโทปทั้งสามนี้ ทำให้นักดาราศาสตร์เข้าใจถึงปฏิกิริยาฟิวชั่นใจกลางดาวฤกษ์ได้เป็นอย่างดีบางไอโซโทปมีความเสถียร บางไอโซโทปก็ไม่เสถียร ซึ่งจะสลายตัว แล้วปลดปล่อยพลังงานออกมา แต่ละไอโซโทปจะถูกตั้งชื่อตามเลขมวล ซึ่งเป็นจำนวนรวมของนิวตรอนกับโปรตอน
- ออกซิเจน 16 (O-16) มีโปรตรอน 8 ตัวกับนิวตรอนอีก 8 ตัว ซึ่งมีความเสถียร
- ออกซิเจน 19 (O-19) มีโปรตรอน 8 ตัวกับนิวตรอนอีก 11 ตัว จะไม่เสถียร โดยมันสลายตัวจนลดปริมาณลงครึ่งหนึ่งอย่างรวดเร็วด้วยเวลาเพียง 26.88 วินาที นั่นหมายความว่า O-19 มีค่าครึ่งชีวิต (Half-life)เป็น 26.88 วินาที
ธาตุบางชนิดก็ไม่มีไอโซโทปที่เสถียร คือ โลหะหนักยูเรเนียม (U) ที่ในธรรมชาติมี 3 ไอโซโทป และทั้งหมดเป็นกัมมันตรังสีที่จะสลายตัวอย่างคงที่จนกลายเป็นธาตุอื่นอย่างช้า ๆ
- ยูเรเนียม-238 (U-238) เป็นไอโซโทปที่พบมากที่สุดของยูเรเนียม มีค่าครึ่งชีวิตเท่ากับ 4.5 พันล้านปี มันจะค่อยๆกลายเป็น ตะกั่ว-206 (Pb-206)
- ยูเรเนียม-235 (U-235) มีค่าครึ่งชีวิต 704 ล้านปี เปลี่ยนเป็นตะกั่ว-207 (Pb-207) ที่เป็นไอโซโทปที่เสถียรกว่า
ข้อมูลนี้เป็นประโยชน์สำหรับนักธรณีวิทยา เพราะการวัดอัตราส่วนระหว่างยูเรเนียมกับตะกั่ว สามารถระบุอายุของหินได้ นอกจากนี้ในทางการแพทย์ยังใช้สารกัมมันตรังสีบางชนิดเพื่อตรวจสอบการไหลเวียนของเลือดศึกษาการเติบโตของกระดูก หรือรังษีวิทยา เป็นต้น
ไอโซโทน (Isotone) และไอโซบาร์ (Isobar) คืออะไร
ไอโซโทน (Isotone)
อะตอมของธาตุต่างชนิดกันที่มีจำนวนนิวตรอนเท่ากัน แต่จำนวนโปรตอน เลขอะตอมและเลขมวลไม่เท่ากัน เช่น 3919K 4020Ca มีนิวตรอนเท่ากัน คือ 20
ไอโซบาร์ (Isobar)
อะตอมของธาตุต่างชนิดกันที่มีเลขมวลเท่ากันแต่เลขอะตอมต่างกัน เช่น 146C 147N
การประยุกต์ใช้ไอโซโทปในทางวิทยาศาสตร์ มีอะไรบ้าง
นักวิทยาศาสตร์ได้นำการวิเคราะห์ไอโซโทป ไปประยุกต์ใช้ในงานทางด้านวิทยาศาสตร์หลายด้าน อาทิเช่น
- โบราณคดี (Archaeology) ศึกษาการกินอาหารของสิ่งมีชีวิตดึกดำบรรพ์
- แหล่งที่มาขอโบราณวัตถุ (Sourcing archaeological materials) การวิเคราะห์คุณสมบัติเพื่อะบุแหล่งที่มาของโบราณวัตถุ เช่น การวิเคราะห์ไอโซโทปของตะกั่ว (Lead Isotope Analysis) ในโบราณวัตถุยุคโลหะ ของเมดิเตอเรเนียน
- นิเวศวิทยา (Ecology) เช่น การประเมินความกว้างของปากแม่น้ำจากการวิเคราะห์สัดส่วนออกซิเจนในเปลือกหอย
- นิติเวชวิทยา (Forensics) เช่น การวิเคาระห์เส้นผม การติดตามเส้นทางยาเสพติด
- ธรณีวิทยา (Geology) การหาอายุวัตถุ
- อุทกวิทยา (Hydrology) การหาอายุและแหล่งที่มาของน้ำ และทิศทางการเคลื่อนตัวในวัฏจักรของน้ำ
- ภูมิกาศบรรพกาลวิทยา (Paleoclimatology) การศึกษาวัฏจักรการเปลี่ยนแปลงแกนหมุนของโลก
การเรียนรู้เกี่ยวกับไอโซโทปของธาตุต่างๆนั้น มีประโยชน์มากกว่าที่เราคิด เพราะสามารถนำไปใช้ในทางวิทยาศาสตร์ เช่น การระบุอายุหิน การเข้าใจปฏิกิริยาฟิวชั่นใจกลางดาวฤกษ์ รวมไปถึงใช้ในวิทยาศาสตร์การแพทย์ เช่น การใช้รังสีในการตรวจสอบการทำงานของอวัยวะในร่างกาย หรือการฉายรังษีรักษามะเร็ง เป็นต้น



